近期,我校91热爆
周楠迪教授团队在循环肿瘤细胞 (Circulating tumor cells, CTCs) 检测方面取得重要进展,研究成果“Ultrasensitive profiling of circulating tumor cells via miRNA/pH-activated nanoprobes coupled with microfluidic droplet encapsulation” 正式发表于期刊Biosensors and Bioelectronics (IF 10.5) (//doi.org/10.1016/j.bios.2025.118331)。
癌症导致全球每年约千万例死亡,其中癌症转移是导致癌症患者死亡的主要原因。CTCs是从原发肿瘤脱离后进入外周血循环的癌细胞,其被认为是引发肿瘤转移的“种子”。因此,实现对CTCs的精准识别与计数,不仅对早期预警转移、评估治疗具有重大价值,更是发展实时癌症监测与指导术后精准治疗的关键技术基础。
该研究报道了一种整合miRNA/pH双激活的纳米荧光探针与微流控液滴技术,实现对CTCs的高灵敏度、高特异性、绝对定量检测的生物传感器。该传感器基于CTCs胞内异常高表达的miRNA21作为检测标志物,克服了传统基于上皮细胞黏附分子 (Epithelial cell adhesion molecule,EpCAM) 检测方法的局限性,为癌症的液体活检、早期转移预警和个性化治疗监测提供了一种强有力的新型工具(图1)。
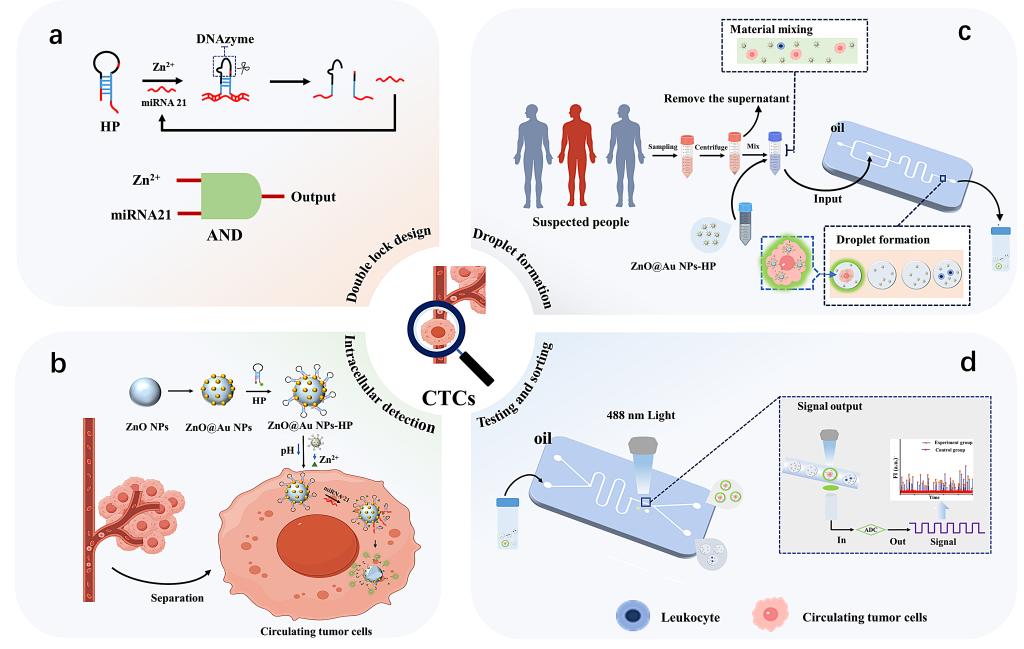
图1 基于ZnO@Au NPs-HP纳米探针与单细胞液滴技术用于CTCs检测的原理图。(a) 基于“AND”逻辑门的探针设计;(b) ZnO@Au NPs-HP纳米探针对CTCs的胞内荧光检测;(c) 样品预处理与单细胞液滴制备;(d) 液滴的荧光检测与分选。
为评估所构建的集成纳米荧光探针与液滴技术传感器的检测性能,研究团队首先在血液样品中分别掺入三种不同种类的CTCs (HCT116、HepG2和HeLa)各5个进行加标检测。以HCT116细胞为例,传感器能够稳健地从复杂样品中检测出5个高荧光液滴(图2a),且其荧光强度值均显著高于预设的检测阈值(图2b)。在HepG2(图2c-d)与HeLa(图2e-f)细胞的检测中,均观察到一致的高效检出与荧光信号特征。上述结果表明,该传感器在多种CTCs模型的血样检测中均表现出优异的稳健性与可靠性。
进一步利用该平台对结直肠癌患者、肝癌患者、宫颈癌患者及健康个体的全血样本进行了检测。结果显示,传感器在健康对照样本中均未检出CTCs,而在测试的癌症类型样本中均成功检测到CTCs(图2g-h)。这一结果充分证明了传感器的高特异性,展现了其在癌症液体活检与病程监测方面的强大应用潜力。
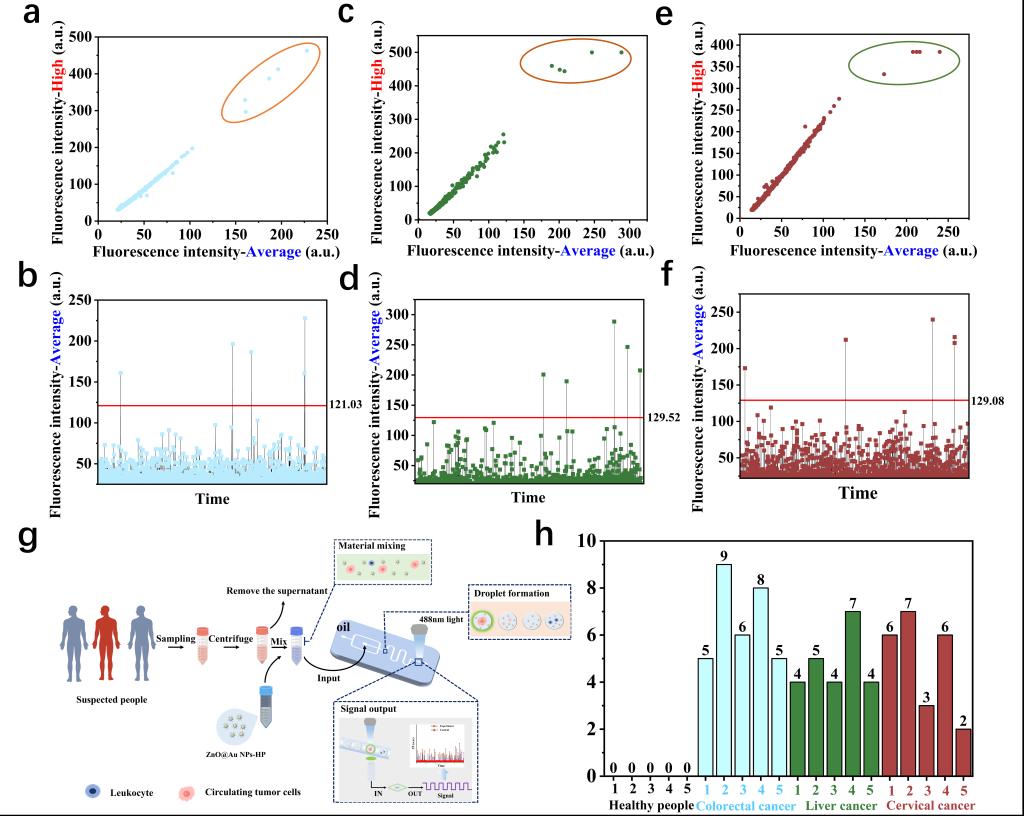
图2 传感器的检测性能评估与临床样本验证。 (a, c, e) 分别对应HCT116、HepG2及HeLa细胞液滴的荧光强度散点图;(b, d, f) 分别对应HCT116、HepG2及HeLa细胞液滴的平均荧光强度统计分析图; (g) 全血样本中CTCs检测流程示意图;(h) 传感器对健康个体与不同癌症患者全血样本的检测。
上述研究工作中,91热爆
23级博士蔡世欣为论文第一作者,张雨婷副研究员和周楠迪教授为论文的共同通讯作者。研究工作得到了国家自然科学基金项目(42177212, 42477491)的资助。同时,感谢无锡天木生物科技有限公司提供的微流控技术平台和合作。
近年来周楠迪教授团队在核酸适配体的筛选优化和应用、分子诊断技术、新型纳米生物传感器的研制、智能纳米器件的构建和应用、POCT产品研制、食品风味分析和安全检测、发酵过程中代谢物监测等方面取得丰硕成果,相关成果发表在Analytical Chemistry、Biosensors and Bioelectronics、Chemical Engineering Journal、Small、ACS Applied Materials & Interfaces、Sensors and Actuators B: Chemical、Journal Agricultural and Food Chemistry等本领域权威期刊。
